AI 智能摘要
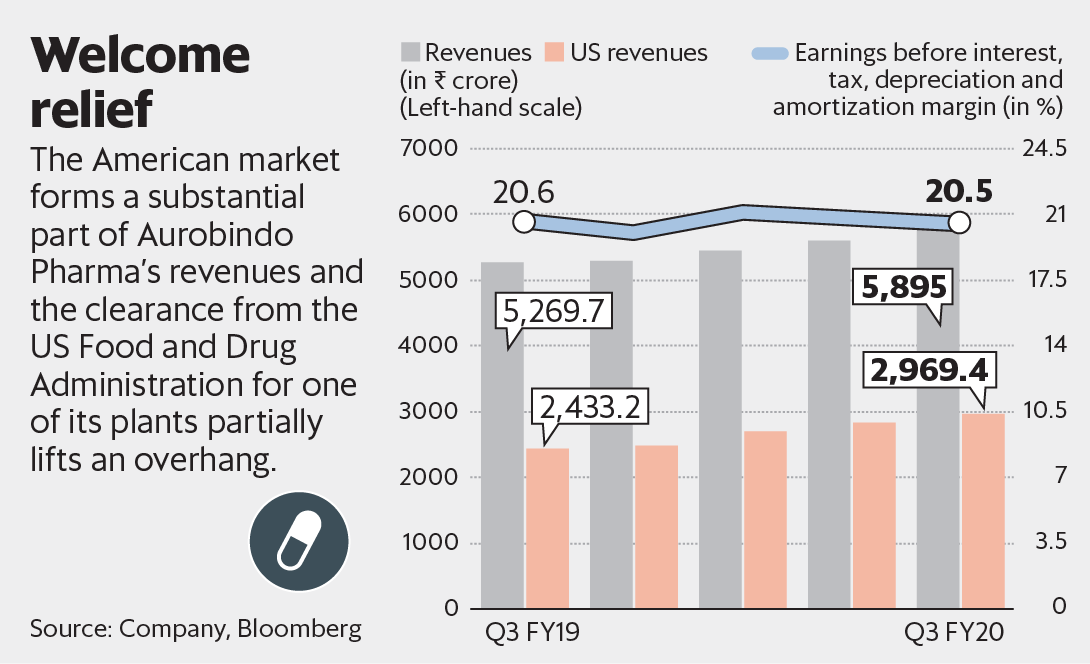
Aurobindo Pharma Ltd从美国食品和药物管理局(US FDA)收到了自愿采取行动(VAI)的暗示,将其悬垂部分解除了其中一部分。但这虽然令人欣慰,但该公司必须快速跟踪在美国的新产品发布,结束对Sandoz的收购并必须从美国监管机构处清除其他工厂。
不过,华尔街对美国FDA的第4单元的VAI感到非常惊讶,因为某些观察本质上要求很高。美国食品和药物管理局还一直在加强制药行业的监管行动,最近这影响了许多印度制药商。最近,Aurobindo还为其其他一些设施收到了官方的行动指示和警告信,因此,这确实受到欢迎。
但是,最近的VAI显示,Aurobindo暂时不必担心此关键的IV单元工厂的新药上市。请注意,IV单元是该公司的重要无菌设施,约占其在美国待审批的简短新药申请(ANDA)的近三分之一。因此,这种植物对于未来的增长至关重要。实际上,该工厂已经产生了很大一部分收入。
 图片:Naveen Kumar Saini / Mint
图片:Naveen Kumar Saini / Mint
“我们的估计已经假定有第四单元的许可;现在,清算使我们在2021/22财年分别对无菌业务的收入预测分别为2.8亿美元和3.43亿美元,”他说。
尽管如此,投资者现在正在展望该公司以多快的速度完成对Sandoz的收购,Sandoz有许多关键产品有望产生可观的收入。
但是,Sandoz的一些主要分销协议有望终止,这可能会阻碍收入增长。不过,Aurobindo仍可以使用Sandoz的三个设施,这有助于加强产品组合以及成本协同效应。
但是,美国FDA仍在对其应进行检查的其他一些工厂进行检修。 “美国食品药品管理局将从2月24日开始在第10单元进行检查,并于4月某个时候开始在Eugia单元进行检查。两者总共容纳62个待审核的ANDA,占待审核批准的40%。这些部门将是未来2-3年的主要增长动力。 Sandoz监管部门的批准是另一个可监控的关键。” BoB Capital Markets Ltd的分析师在一份报告中说。
不过,Aurobindo股票在过去两天内上涨了19%,这使其在现阶段的价格相当昂贵。毕竟,一些增长挑战仍然存在。此外,扩大其新设施和产品批准的步伐将是未来库存前景的关键。
话题
Aurobindo Pharma美国FDA
